Substituierte aromatische Verbindungen
IMPP-Score: 6.5
Eigenschaften und Reaktivitäten substituierter Aromaten
Substituierte Aromaten sind faszinierende Verbindungen in der organischen Chemie, bei denen funktionelle Gruppen an ein Aromatensystem gebunden sind. Diese Substitutionen haben einen großen Einfluss auf die chemischen Eigenschaften des Aromaten. Lasst uns gemeinsam untersuchen, wie diese Substituenten die Elektronendichte und somit die Reaktivität eines Aromaten beeinflussen.
Elektronenschiebende und elektronenziehende Effekte
Gruppen, die Elektronendichte in den aromatischen Ring einspeisen, werden als elektronenschiebende Gruppen bezeichnet. Dies geschieht hauptsächlich über zwei Effekte:
Induktiver Effekt (+I): Diese Gruppen schieben Elektronendichte durch Sigma-Bindungen in den Ring; typische +I-Gruppen sind Alkylgruppen.
Mesomerer Effekt (+M): Gruppen mit freien Elektronenpaaren an einem Atom, das direkt mit dem Ring verbunden ist, können Elektronendichte durch Pi-Bindungen in den Ring einspeisen. Ein Beispiel ist die Aminogruppe.
Im Gegensatz dazu ziehen elektronenziehende Gruppen Elektronendichte aus dem Ring heraus, was zu einem Elektronenmangel führt. Auch dies kann auf zwei Arten geschehen:
Induktiver Effekt (-I): Stark elektronegative Atome wie Halogene zeigen diesen Effekt, indem sie Elektronendichte über Sigma-Bindungen abziehen.
Mesomerer Effekt (-M): Gruppen wie die Nitrogruppe entziehen Elektronendichte durch Pi-Bindungen aus dem Ring.
Auswirkungen auf die elektrophile aromatische Substitution (EAS)
Elektrophile aromatische Substitutionen sind Reaktionen, bei denen ein Elektrophil einen Wasserstoff im Aromaten ersetzt. Der Substituent bestimmt, wo die Substitution stattfindet:
Ortho/Para-Direktoren: Elektronenschiebende Gruppen erhöhen die Elektronendichte an den ortho- und para-Positionen, was zu einer bevorzugten Substitution dort führt. Diese Gruppen aktivieren den Ring auch gegenüber elektrophilen Angriffen.
Meta-Direktoren: Elektronenziehende Gruppen senken die Elektronendichte an ortho- und para-Positionen, sodass Elektrophile bevorzugt an der meta-Position angreifen. Diese Gruppen deaktivieren den Ring zudem für elektrophile Angriffe.
Substituenteneffekte 1. und 2. Ordnung
Beim Umgang mit Reaktivität und Positionierung von weiteren Substituenten gibt es Unterschiede zwischen Substituenten 1. und 2. Ordnung. Erstere dirigieren in ortho-/para-Position und können entweder aktivierend oder nur schwach deaktivierend sein (z.B. Methyl, Methoxy). Zweitere leiten typischerweise in die meta-Position und sind stark deaktivierende Substituenten (z.B. Nitro-, Sulfonsäuregruppen).
Säurestärke und Basizität
Substituenten können die Acidität von Aromaten stark beeinflussen:
Erhöhte Säurestärke: Dies tritt auf, wenn elektronenziehende Substituenten die Elektronendichte an einer funktionellen Gruppe wie COOH oder OH verringern und dadurch die Abspaltung von Protonen erleichtern.
Verminderte Basizität: Elektronenschiebende Gruppen erhöhen die Elektronendichte an N-haltigen Gruppen, was die Neigung verringert, ihr freies Elektronenpaar mit einem Proton zu teilen, und so die Basizität senkt.
Das IMPP fragt besonders gerne nach diesen Effekten wegen ihrer breiten Anwendbarkeit und den Auswirkungen auf die Acidität/Basizität organischer Verbindungen.
Stabilisierung durch Phenylgruppen
Phenylgruppen können eine stabilisierende Wirkung in organischen Molekülen haben. Beispiele sind Phenylketone wie Acetophenon, bei denen die Phenylgruppe die Carbonylgruppe durch Resonanz stabilisiert. Auch die Acidität von Phenolen und Carbonsäuren wird durch solche aromatischen Substituenten beeinflusst.
Herstellungsprozesse und -mechanismen für substituierte Aromaten
Um komplexe Verbindungen wie substituierte Aromaten zu synthetisieren, musst du verschiedene Herstellungsprozesse verstehen und anwenden können. Dabei spielen insbesondere elektrophile Substitutionsreaktionen (SE-Reaktionen) eine zentrale Rolle. Zuerst werden wir einige bedeutende Synthesemethoden und dann feinere mechanistische Details und Besonderheiten betrachten.
Friedel-Crafts-Alkylierungen und -Acylierungen
Im Rahmen der Friedel-Crafts-Alkylierung oder -Acylierung binden Alkyl- oder Acylgruppen an Aromaten. Dabei sind Lewis-Säuren, wie z.B. AlCl₃ oder FeCl₃, notwendige Katalysatoren. Ein nützliches Beispiel, das du dir merken solltest, ist die Herstellung von Acetophenon aus Benzol, bei der eine Acylierung mit einem Acylchlorid im Gegenwart eines Katalysators stattfindet.
Es ist wichtig, die Bildung des Elektrophils und die Komplexierung des Katalysators mit dem Reagens zu verstehen, da das IMPP häufig nach diesen Schritten fragt.
Bei der Friedel-Crafts-Alkylierung kann es zu Umlagerungen kommen, die zu einem Gemisch verschiedener Produkte führen können. Dies ist durch die Stabilität von Carbeniumionen bedingt.
Carbeniumionen können umlagern, um eine stabilere Form zu erreichen. Dies bedeutet, dass das beobachtete Produkt möglicherweise nicht dem direkt aus dem substituierten Alkylchlorid gebildeten Carbeniumion entspricht.
Sulfonierung von Benzol
Bei der Sulfonierung wird eine Sulfonsäuregruppe (-SO₃H) in einen Aromaten eingeführt. Hierzu wird oft rauchende Schwefelsäure verwendet. Diese Reaktion ist bei der Synthese von Detergentien und Farbstoffen wichtig.
Kolbe-Schmitt-Reaktion
Ein weiteres Thema, das oft vom IMPP abgefragt wird, ist die Kolbe-Schmitt-Reaktion, durch die eine Carboxylgruppe in den Aromaten eingeführt wird – häufig am Beispiel von Salicylsäure aus Natriumphenolat und CO₂.
Vilsmeier-Haack Reaktion
Durch eine Vilsmeier-Haack Reaktion kann eine Formylgruppe (-CHO) am Aromaten eingeführt werden. Denke daran: Die Reaktivität von Aromaten wie Nitrobenzen ist niedriger, wodurch nicht alle Aromaten gut für diese Reaktion geeignet sind.
Halogenierung und Chlormethylierung
Die Halogenierung und die Chlormethylierung sind Beispiele für elektrophile Substitutionen, bei denen Halogenatome bzw. eine -CH₂Cl-Gruppe in einen Aromaten eingeführt werden.
Halogenierungsreaktionen sind oft exotherm und erfordern eine präzise Handhabung.
Azokupplung
Die Azokupplung ist besonders für die Herstellung von Azofarbstoffen relevant, bei der Diazoniumsalze mit aktivierten Aromaten reagieren. Die Elektronendichte des Aromaten wirkt als entscheidender Faktor.
Synthese von Phenolen
Die Synthese von Phenolen, wie z.B. durch das Cumenhydroperoxid-Verfahren, verdeutlicht, wie Substituenten wie Alkylgruppen die Reaktivität und Eigenschaften eines Aromaten verändern.
Gerade die Herstellung von Phenol nach dem Cumenhydroperoxid-Verfahren ist ein beliebtes Prüfungsthema.
Reaktionen und Anwendungen von Halogenaromaten
Einleitung zu Halogenaromaten
Halogenaromaten sind spezielle aromatische Verbindungen, bei denen mindestens ein Wasserstoffatom des Aromaten durch ein Halogenatom (Fluor, Chlor, Brom oder Iod) ersetzt ist. Diese Einführung hat große Auswirkungen auf die Chemie des Aromaten – von Reaktivität bis hin zu möglichen Anwendungen.
Reaktivität von Halogenaromaten
Bei elektrophilen aromatischen Substitutionen beeinflusst das vorhandene Halogen durch seinen elektronenziehenden induktiven Effekt (-I-Effekt) und seinen elektronenschiebenden mesomeren Effekt (+M-Effekt) den Aromaten. Halogene sind desaktivierend und zugleich ortho-/para-dirigierende Gruppen.
Beim Übertragen auf Reaktionen wie Nitrierungen oder Sulfonierungen bedeutet dies, dass Halogenaromaten weniger reaktiv sind als Benzol, aber dennoch elektrophile Angriffe in ortho- und para-Stellung zum Halogensubstituenten bevorzugen.
Sandmeyer-Reaktionen
Die Sandmeyer-Reaktion ist eine wichtige Methode zur Umwandlung von Aminogruppen in Halogenaromaten mithilfe von Diazoniumsalzen. Sie bietet einen Zugang zu Halogenaromaten aus Anilinen und wird oft im Zusammenhang mit Chlor- und Bromaromaten verwendet. Iodaromaten können durch eine ähnliche “pseudo-Sandmeyer-Reaktion” dargestellt werden.
Verhalten von Halogenaromaten gegenüber starken Basen
Halogenaromaten zeigen aufgrund der Bindungsstärke zu Halogenen unterschiedliche Reaktivitäten. Besonders Aryljodide können unter basischen Bedingungen durch nucleophile Substitutionsreaktionen umgesetzt werden.
Funktionalisierung von Halogenaromaten
Verständnis dafür haben, dass Halogenaromaten ideale Ausgangsstoffe zur Einführung weiterer Funktionalitäten sind. Zum Beispiel kann das Halogen durch eine Vielzahl nucleophiler Gruppen mithilfe von Kupplungsreaktionen wie der Suzuki-Kupplung ersetzt werden.
Die Suzuki-Kupplung ist eine Kreuzkupplungsreaktion, die Boronsäurederivate verwendet und in der Synthese vieler biologisch aktiver Substanzen und Materialien von Bedeutung ist.
Besonderheiten bei Chlor-, Brom- und Iodaromaten
- Chloraromaten: Sehr stabil, oft benötigen sie starke Lewis-Säuren oder spezielle Bedingungen, um zu reagieren.
- Bromaromaten: Reaktiver als Chloraromaten, häufig für EAS-Reaktionen unter milderen Bedingungen verwendet.
- Iodaromaten: Am reaktivsten, können unter milden Bedingungen nucleophil substituiert werden.
Tautomerie bei substituierten Aromaten
Tautomerie beschreibt das Phänomen, bei dem ein Molekül innerhalb von isomeren Formen, Tautomeren, über ein Gleichgewicht selbst wechselt. Diese Isomerie involviert in der Regel eine Umlagerung von Protonen zusammen mit einer Verschiebung von Bindungen. Die Tautomerie bei substituierten Aromaten ist in der organischen Chemie relevant, weil sie die physikalischen, chemischen und biologischen Eigenschaften der Verbindung beeinflussen kann. Um dies zu verstehen, ist es entscheidend, den Einfluss von Substituenten auf den Aromaten und das Auftreten der Tautomie in solchen Systemen zu erkennen.
Keto-Enol-Tautomerie
Die Keto-Enol-Tautomerie ist ein klassisches Beispiel für tautomerische Gleichgewichte, wobei ein Aldehyd oder Keton (Carbonylgruppe) in ein Enol (eine Alken-Gruppe mit einem Hydroxyl-Substituenten) umgewandelt wird. Bei substituierten Aromaten beeinflussen elektronenliefernde Substituenten die Stabilität des Enol-Tautomeren durch Resonanzstabilisierung der Doppelbindung, während elektronenziehende Substituenten die Stabilität der Keto-Form erhöhen können.
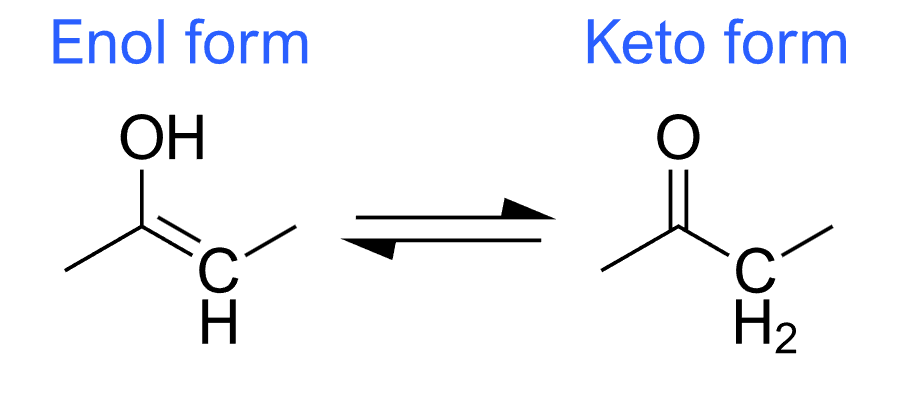
Phenol-Keto Tautomerie
Die Phenol-Keto-Tautomerie ist eine spezielle Form der Tautomerie, die bei der Hydroxygruppe von Phenolen auftritt. Ein bekanntes Beispiel ist die Salicylsäure, bei der die Tautomerie zwischen der Keto-Form (einer C=O Bindung) und einer enolischen Form (einem aromatischen Ring mit einer OH-Gruppe) besteht. Dies ist insbesondere relevant für die Eigenschaften und die Reaktivität der Verbindung, z.B. für deren Säurestärke und für die Wasserstoffbrückenbildung mit anderen Molekülen.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Struktur von Anilin Grafik: Chem Sim 2001, Structural formula of aniline, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Elektrophile aromatische Substitution Grafik: Jü, Electrophilic Substitution V.1, CC0 1.0↩︎
Credits Friedel-Crafts-Alkylierung Grafik: Kado6450, Friedel-Crafts-Alkylierung 1, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Dibrombenzol Grafik: Yikrazuul, M-Dibromobenzene, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Keto-Enol-Tautomerie Grafik: Vaccinationist, Tautomers, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
