Schwefelwasserstoffe
IMPP-Score: 0.9
Struktur, Eigenschaften und Reaktivität von Schwefelwasserstoff und seinen Salzen
Schwefelwasserstoff, mit der chemischen Formel \(H_2S\), ist ein äußerst interessantes Molekül, das sowohl in der Natur vorkommt als auch synthetisiert werden kann. Im Folgenden schauen wir uns dieses Molekül und seine Salze etwas genauer an.
Molekulare Struktur von H2S
Schwefelwasserstoff ist ein gewinkeltes Molekül, ähnlich der Struktur von Wasser (\(H_2O\)). Doch obwohl die Strukturen ähnlich sind, weisen die beiden Verbindungen deutliche Unterschiede auf. Schwefel im \(H_2S\) trägt die Oxidationszahl -II, im Gegensatz zu Sauerstoff in Wasser, der die Oxidationszahl -II trägt, während Wasserstoff in beiden Verbindungen die Oxidationszahl +I aufweist.
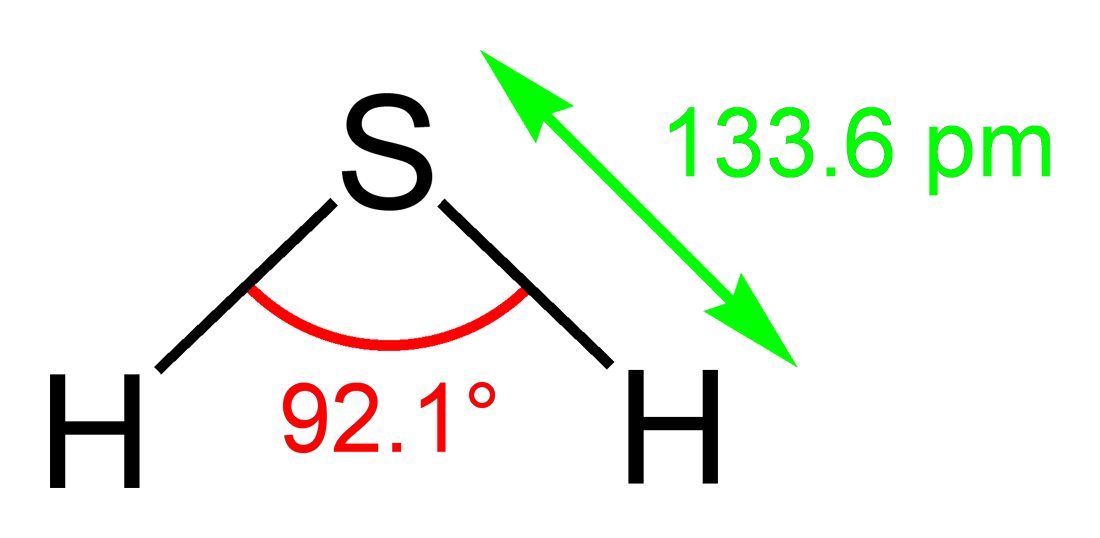
Physikalische Eigenschaften von H2S
\(H_2S\) ist ein farbloses Gas, bekannt für seinen unangenehmen Geruch nach faulen Eiern. Mit einem Siedepunkt von etwa -\(60 \, ^\circ C\) ist es unter Standardbedingungen gasförmig. Dabei ist es wichtig zu erwähnen, dass Schwefelwasserstoff giftig ist und in höheren Konzentrationen sogar tödlich wirken kann.
Das IMPP fragt besonders gerne nach den physikalischen Eigenschaften und der Toxizität von \(H_2S\). Merkt euch den Charakter als schwache Säure und die potentielle Gefahr, die von diesem Gas ausgeht.
Säureeigenschaften von H2S
\(H_2S\) ist eine stärkere Säure als \(H_2O\), was sich in den pKs-Werten von etwa 7 für die erste und 12,92 für die zweite Dissoziationsstufe widerspiegelt. Das bedeutet, dass \(H_2S\), wenn es in wässriger Lösung vorliegt, leicht durch Basen wie Natronlauge deprotoniert werden kann, wobei Salze wie Natriumhydrogensulfid entstehen.
Herstellung von H2S
Im Labor kann \(H_2S\) durch die Reaktion von Eisensulfid (\(FeS\)) mit Salzsäure (\(HCl\)) erzeugt werden. Dies ist eine nützliche Methode zur Herstellung des Gases für experimentelle Zwecke.
Oxidationsreaktionen von H2S
Interessanterweise kann \(H_2S\) je nach Sauerstoffzufuhr zu elementarem Schwefel oder zu Schwefeldioxid (\(SO_2\)) oxidiert werden:
Bei geringer Sauerstoffzufuhr: \[ 2H_2S + O_2 \rightarrow 2S + 2H_2O \]
Bei hoher Sauerstoffzufuhr: \[ 2H_2S + 3O_2 \rightarrow 2SO_2 + 2H_2O \]
Zink ist ungeeignet, um die Oxidation von \(H_2S\) zu elementarem Schwefel zu bewirken. Dies ist eine Prüfungsdetail, das IMPP könnte in einem Examen nach solchen spezifischen Reaktivitäten fragen.
Thiosulfate und deren Reaktionen
Thiosulfat (\(S_2O_3^{2-}\)) ist ein Salz, das in vielen chemischen Reaktionen eine bedeutende Rolle spielt. Es kann durch stärkere Oxidationsmittel zu Sulfat oxidiert werden:
\[ 2S_2O_3^{2-} + I_2 \rightarrow S_4O_6^{2-} + 2I^- \]
In Gegenwart von Chlor kann Thiosulfat völlig zu Sulfat oxidiert werden. Solche Reaktionen sind im klinischen und technischen Bereich von Bedeutung und werden auch in der analytischen Chemie angewendet.
Komproportionierungsreaktionen
Ein spezieller Reaktionstyp, der Komproportionierung, ermöglicht die Gewinnung von elementarem Schwefel aus \(H_2S\) durch seine Reaktion mit Schwefel in einer unterschiedlichen Oxidationsstufe als in Schwefelwasserstoff. Dies zeigt, wie vielseitig die Chemie des Schwefels sein kann:
\[ H_2S + S_0 \rightleftharpoons 3S^{-2} + 2H^+ \]
Gleichgewichtsreaktionen
In Gleichgewichtsreaktionen mit Sulfiden können verschiedene Oxidationsstufen des Schwefels involviert sein. Die Kenntnis dieser Reaktionen ist wesentlich für das Verständnis der anorganischen Chemie des Schwefels.
Schlussfolgerung
Insgesamt ist die Chemie von Schwefelwasserstoff und seinen Salzen enorm vielseitig und kann oft verwirrend erscheinen. Es ist wichtig, sowohl die grundsätzlichen Eigenschaften von Schwefelwasserstoff zu verstehen, als auch die Fähigkeit zu haben, zu höher- oder niedriger oxidierten Schwefelverbindungen zu wechseln. Genauso wichtig ist das Verständnis für die Salze des H2S, vor allem für die Thiosulfate und ihre Reaktionen mit Oxidationsmitteln. Diese Kenntnisse sind nicht nur im Labor, sondern auch in industriellen Prozessen und der Umweltchemie von großer Bedeutung.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Struktur von Schwefelwasserstoff Grafik: , Hydrogen-sulfide-2D, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
