Nomenklatur, Eigenschaften und Stereochemie
IMPP-Score: 0.9
Nomenklatur
Die Nomenklatur von Komplexverbindungen ist nicht nur wichtig für eine eindeutige Kommunikation in der Chemie, sondern sie verrät auch grundlegende Eigenschaften des Komplexes selbst. Bei der Benennung von Komplexen beginnen wir immer mit der Anzahl und Art der Liganden. Anionische Liganden bekommen hierbei oft ein Suffix -o, wie zum Beispiel Chlorido für Chlor oder Cyanido für das Cyanid-Ion.
Das IMPP legt oft Wert darauf, dass ihr die IUPAC-Nomenklatur sicher beherrscht. Achte darauf, Liganden alphabetisch zu ordnen, korrekte Präfixe für Mehrfachliganden zu verwenden und den Oxidationszustand des Zentralatoms in römischen Ziffern anzugeben.
Beispiel für einen Komplex mit Ammoniak als Ligand
Bei Komplexen, die Ammoniak als Ligand enthalten, verwendest du den spezifischen Ligandennamen ‘Ammin’. Hat ein Komplex zum Beispiel die Summenformel [Cr(NH3)6]Cl3, benennen wir ihn als Hexaamminchrom(III)-chlorid.
Merke: Das Zentralatom mit seiner Oxidationszahl (in römischen Ziffern) folgt auf die Liganden – in unserem Beispiel Chrom(III). Ist das Komplex-Ion ein Anion, endet der Name des Zentralatoms auf -at.
Eigenschaften und Stereochemie von Komplexen
Um die Eigenschaften von Komplexen verstehen zu können, ist es entscheidend, die koordinative Struktur und Stereochemie zu kennen. Die Koordination gibt an, wie viele Liganden direkt an das Zentralmetallion gebunden sind.
Geometrien basierend auf Koordinationszahlen
- Kleine Koordinationszahlen (2, 4): Bei der Koordinationszahl 2 beobachten wir oft eine lineare Geometrie. Komplexe mit der Koordinationszahl 4 können quadratisch planar oder tetraedrisch sein. Platin(II)-Ionen bilden zum Beispiel häufig quadratisch-planare Strukturen in Komplexen.
Isomerie und Chelatkomplexe
Die räumliche Anordnung der Liganden kann unterschiedliche Isomere erzeugen. Bei Komplexen mit der Koordinationszahl 4 oder 6 können cis/trans-Isomere auftreten. Diese unterscheiden sich darin, dass bei cis-Isomeren die gleichen Liganden auf der gleichen Seite des Zentralatoms liegen, während sie bei trans-Isomeren gegenüberliegen.
Beispiel: Im [Pt(NH3)2Cl2]-Komplex können die beiden Chlorido-Liganden nebeneinander (cis) oder gegenüberliegend (trans) platziert sein.
Mehrzähnige Liganden, die mit mehreren Bindungen an ein Zentralion koordinieren und somit Ringstrukturen ausbilden, bilden sogenannte Chelatkomplexe. Beispiele hierfür sind das Häm in Hämoglobin oder das Chlorophyll in Pflanzen.
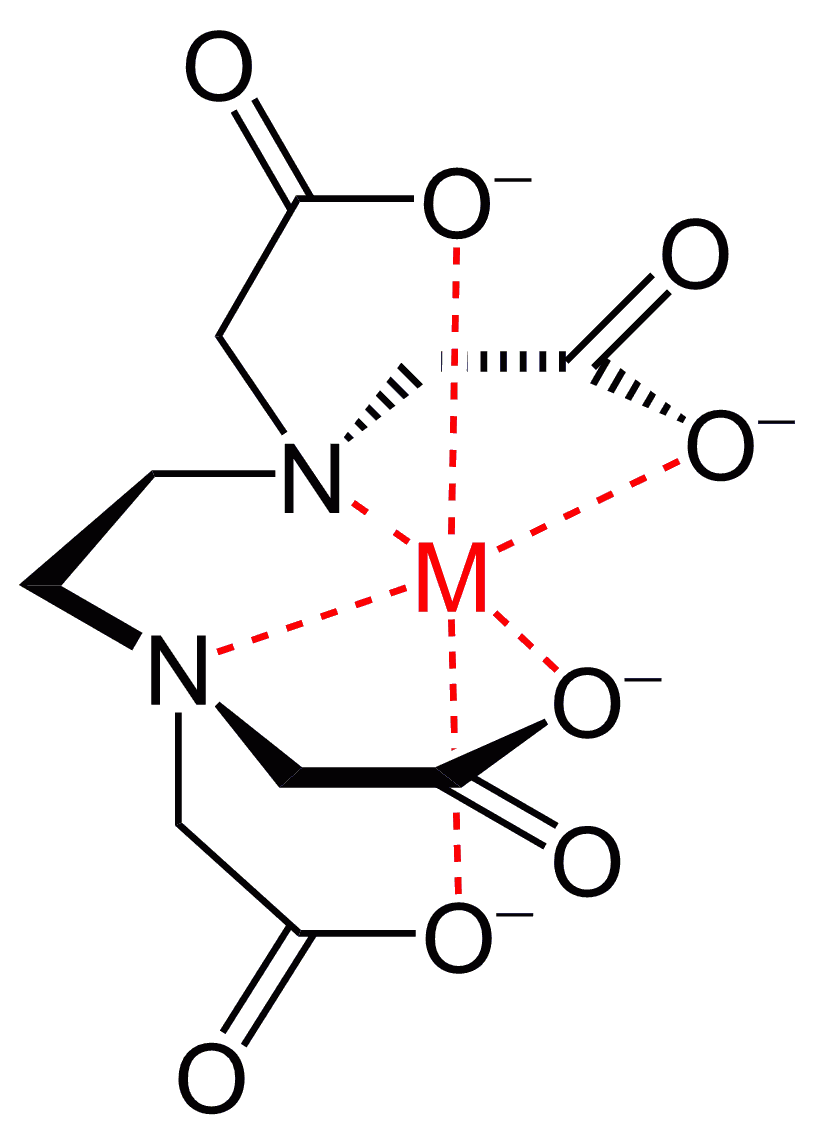
Als Beispiel sei hier einmal ein EDTA-Metallion-Chelatkomplex dargestellt. Man sieht sehr gut, dass das Metallion als Zentralteilchen von mehreren Elektronenpaar eines einzelnen Liganden “angegriffen” wird.
Verwechsle nicht geometrische Isomere (cis/trans) mit optischen Isomeren. Bei Komplexen mit vier unterschiedlichen Liganden kann Chiralität, also nicht überlagerbare Spiegelbildisomerie, auftreten. Gerade solche feinen Unterschiede sind oft Gegenstand von Prüfungsfragen.
Ladungen und Komplexbildungskonstante
Die Gesamtladung eines Komplexes ergibt sich aus der Ladung des Zentralions und der Summe der Ladungen der Liganden. Kenne die Formeln und wie du sie für die Berechnung der Komplex-Bildungskonstante Kg verwenden kannst, die ein Maß für die Stabilität des Komplexes ist:
\[Kg=\frac{[\text{Komplex}]}{[\text{Zentralion}] \cdot [\text{Ligand}]^n}\]
Beispiel: Für das Hexacyanidoferrat(II) [Fe(CN)6]4- ergibt sich eine oktaedrische Geometrie mit einer Koordinationszahl von 6. Verstehe, wie diese Geometrie die Stabilität und die Eigenschaften des Komplexes beeinflusst.
Stereochemie
Die Stereochemie befasst sich mit der räumlichen Anordnung der Atome in einem Molekül und somit auch in Komplexverbindungen. Kenntnisse über Enantiomere, also Moleküle, die wie Bild und Spiegelbild zueinander sind, und andere Arten der Isomerie sind essentiell, um die Eigenschaften der Komplexe zu verstehen. Isomere können unterschiedliche chemische und physikalische Eigenschaften aufweisen.
Beispiel: Betrachte den Komplex [Fe(CN)5NO]2-, der eine Koordinationszahl von 6 aufweist. Erkunde, welche verschiedenen Isomere sich ergeben können und wie ihre Eigenschaften variieren können.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Chelatkomplex EDTA Grafik: Shaddack at English Wikipedia, Metal-EDTA, marked as public domain, more details on Wikimedia Commons↩︎