Redoxreaktionen
IMPP-Score: 0.4
Grundlagen und Aufstellen von Redoxreaktionen
Erkennung von Redoxreaktionen anhand von Oxidationszahlen
Redoxreaktionen sind chemische Reaktionen, in denen Elektronen von einem Reaktionspartner auf einen anderen übertragen werden. Ein wichtiges Werkzeug, um solche Redoxprozesse zu erkennen, sind die Oxidationszahlen. Ändern sich die Oxidationszahlen von Elementen während einer Reaktion, kannst du davon ausgehen, dass eine Redoxreaktion stattfindet. Die Oxidationszahl gibt an, wie viele Elektronen ein Atom im Vergleich zu einem freien, isolierten Atom theoretisch weniger oder mehr hat.
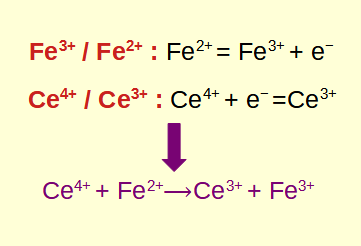
Das IMPP fragt besonders gerne nach Veränderungen der Oxidationszahlen, da dies ein klares Indiz für eine Redoxreaktion ist.
Das Prinzip der Elektroneutralität
Das Prinzip der Elektroneutralität ist fundamental beim Aufstellen von Redoxgleichungen. Es besagt, dass die Gesamtladungen auf beiden Seiten einer chemischen Gleichung gleich sein müssen. Beim Ausgleich von Redoxgleichungen sind also nicht nur die Massen, sondern auch die Ladungen der Reaktanden beiderseits des Reaktionspfeils auszugleichen.
Aufstellen von Redoxgleichungen
Schritt 1: Identifizieren der Reduktion und Oxidation
Eine Redoxreaktion besteht aus zwei Teilprozessen: der Oxidation, bei der Elektronen abgegeben werden, und der Reduktion, bei der Elektronen aufgenommen werden. Identifiziere die Stoffe, die oxidiert und reduziert werden, indem du die Änderung der Oxidationszahlen prüfst.
Schritt 2: Formulieren der Teilreaktionen
Stelle für das Oxidations- und Reduktionsmittel je eine Teilgleichung auf, in der die Änderungen der Oxidationszahlen und die Elektronenaufnahme bzw. -abgabe zu sehen sind. Diese Gleichungen werden oft als Halbreaktionen bezeichnet.
Schritt 3: Ausgleichen von Atomen und Ladungen
Zuerst gleicht man alle Atome außer Wasserstoff und Sauerstoff aus. Danach folgen Wasserstoff mithilfe von Wasserstoffionen (H⁺) oder Wasser (H₂O) und Sauerstoff mithilfe von Wasser. Um die Ladungen auf beiden Seiten der Gleichungen auszugleichen, benutzt man elektrisch geladene Teilchen, z.B. Elektronen (e⁻) bei Reduktion bzw. Oxidation.
Schritt 4: Bilanzierung der Elektronen
Stelle sicher, dass die Anzahl der Elektronen, die in der Oxidation abgegeben werden, mit der Anzahl der Elektronen, die in der Reduktion aufgenommen werden, übereinstimmt. Ist das nicht der Fall, müssen die Halbreaktionen mit entsprechenden Koeffizienten so multipliziert werden, dass die Elektronenbilanz aufgeht.
Schritt 5: Zusammenführen der Teilreaktionen
Füge die Halbreaktionen zusammen und kürze dabei die Elektronen heraus, die auf beiden Seiten der Gleichung stehen. Prüfe die Massen- und Ladungsbilanz und stelle sicher, dass die Gleichung jetzt ausgeglichen ist.
Beispiele
Oxidation von Sulfitionen durch Dichromationen:
Zu Beginn stellst du die Teilreaktionen auf und gleicht Atome und Ladungen aus. Danach wirst du finden, dass drei Sulfitionen zwei Elektronen abgeben, während jedes Dichromation sechs Elektronen aufnimmt. Durch Multiplikation der Oxidationsreaktion mit drei und der Reduktionsreaktion mit einem, erhältst du eine ausgeglichene Gesamtreaktion.
Reaktion von Hypobromit mit Chrom(III):
Hier ist das Prinzip der Elektroneutralität wichtig, um das richtige Verhältnis der Reaktionspartner zu finden. Passe die Stöchiometrie so an, dass die Anzahl der übertragenen Elektronen im Oxidations- und im Reduktionsmittel identisch ist.
Stöchiometrische Berechnungen in Redoxreaktionen
Die stöchiometrische Berechnung in Redoxreaktionen hilft dir, das korrekte Verhältnis der Reaktanten zueinander zu bestimmen. Dabei musst du die Äquivalenz von abgegebenen und aufgenommenen Elektronen sicherstellen.
Überprüfe immer die Richtigkeit deiner Redoxgleichungen, indem du sicherstellst, dass alle Atome und Ladungen ausgeglichen sind. Fehlerquellen können etwa in einer falschen Bestimmung der Oxidationszahlen oder einer inkorrekten Ladungsbilanz liegen.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Beispiel einer Redoxreaktion Grafik: Grogu60, Reaction doxydoréduction entre cérium IV et fer II, CC BY-SA 4.0↩︎
