Thermodynamik
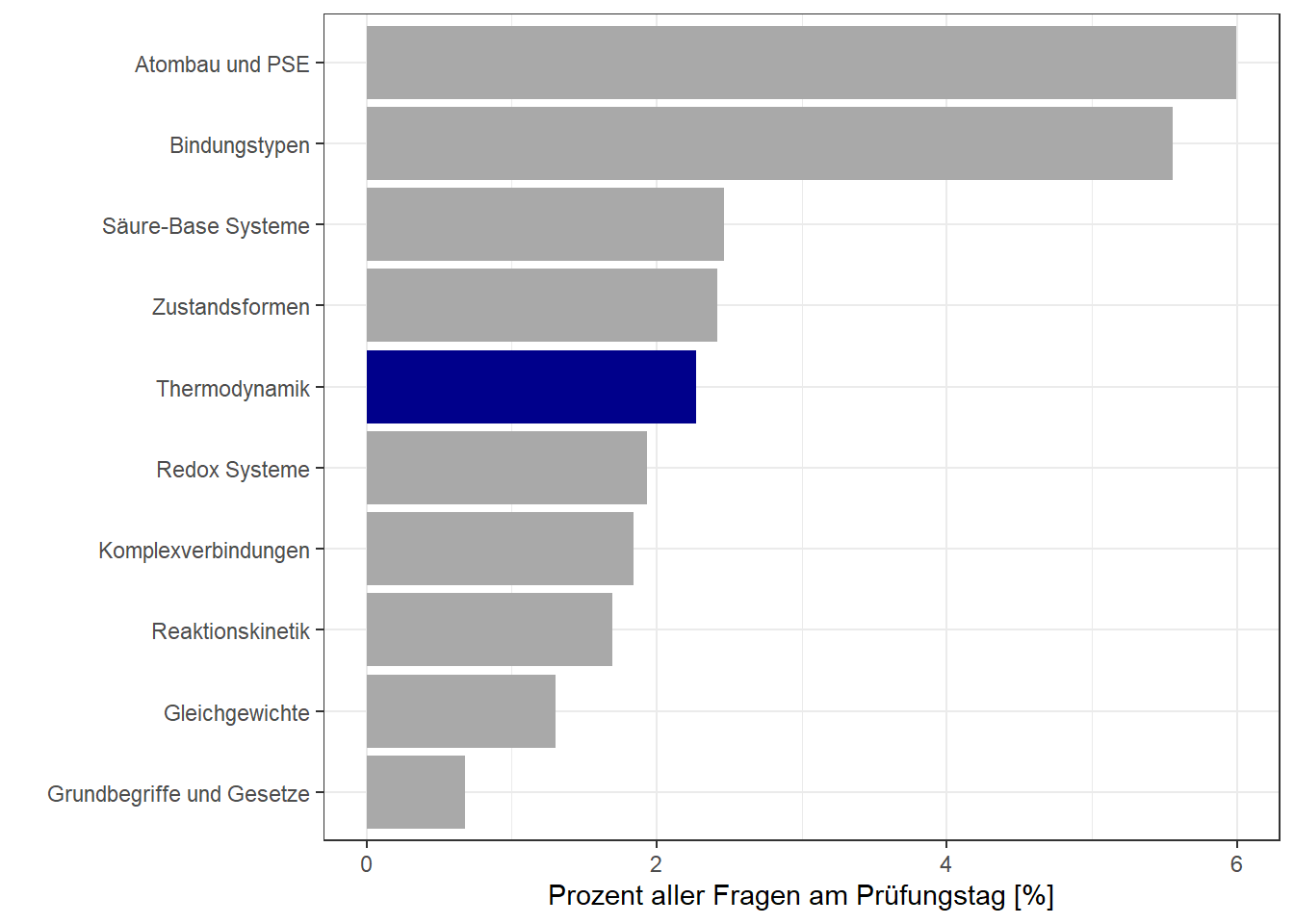
IMPP-Score: 2.2
Tauchen wir nun tief in die Welt der Thermodynamik chemischer Reaktionen ein, einem Kerngebiet, das die Energie und Transformationen von Stoffen beschreibt. Dieser komplexe Themenbereich enthüllt, wie chemische Prozesse auf energetischer Ebene ablaufen.
Zunächst setzen wir uns mit Systemen auseinander und klären, wie man chemische Reaktionen von ihrer Umgebung abgrenzt und welche Arten von Systemen es gibt. Dies bildet die grundlegende Basis für alle weiterführenden Betrachtungen.
Daraufhin wenden wir uns den Zustandsgrößen und Funktionen geschlossener Systeme zu. Ihr lernt, wichtige Parameter wie Druck, Volumen und Temperatur zu verstehen und wie diese sich auf Reaktionen auswirken.
Weiter geht es mit dem 1. Hauptsatz der Thermodynamik, der die Grundlage für das Verständnis der Energieerhaltung in chemischen Systemen legt.
Im Anschluss klärt der 2. Hauptsatz der Thermodynamik über die Richtung und Spontanität von Prozessen auf und führt den wichtigen Begriff der Entropie ein.
Der 3. Hauptsatz der Thermodynamik wird den Scheinwerfer auf das Verhalten von Systemen bei Annäherung an den absoluten Temperaturnullpunkt richten.
Die Gibbs-Helmholtz-Gleichung wird als mächtiges Werkzeug präsentiert, welches euch befähigt, die Freie Enthalpie von Reaktionen zu berechnen und Vorhersagen über ihre Spontanität zu treffen.
Abschließend beschäftigen wir uns mit den Kriterien für den Reaktionsablauf in geschlossenen Systemen und beleuchten, welche Bedingungen erfüllt sein müssen, damit chemische Reaktionen ablaufen können.
Jedes dieser Kapitel liefert euch wertvolles Wissen, um die energetischen Aspekte chemischer Reaktionen zu durchdringen und für das Staatsexamen gewappnet zu sein.
Statistische Auswertung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
