Alkane und Cycloalkane
IMPP-Score: 0.8
Strukturelle Grundlagen von Alkanen und Cycloalkanen
Alkane, auch Paraffine genannt, sind die einfachsten Verbindungen in der organischen Chemie und bestehen nur aus Kohlenstoff (C) und Wasserstoff (H). Ihre allgemeine Formel lautet \(C_nH_{2n+2}\). Sie enthalten nur Einfachbindungen und sind daher gesättigte Kohlenwasserstoffe. Aufgrund ihrer Nichtpolarität und Sättigung gelten Alkane als relativ reaktionsträge.
Cycloalkane sind Alkane, die in Form von Ringstrukturen vorliegen. Ihre allgemeine Formel ist \(C_nH_{2n}\). Cycloalkane sind aufgrund ihrer Ringspannung und abweichenden Bindungswinkel (im Vergleich zu den idealen 109,5° von sp³-hybridisierten Kohlenstoffatomen) reaktiver als ihre nicht-zyklischen Gegenstücke.
Du solltest dir auch die Unterschiede in den Strukturen und damit einhergehenden Eigenschaften von Alkanen und Cycloalkanen einprägen, insbesondere, wie die Ringspannung Cycloalkane beeinflusst.
Denke immer daran, dass Cycloalkane aufgrund ihrer Ringspannung besondere chemische Eigenschaften aufweisen.
Konformationen des Cyclohexans und anderer Cycloalkane
Sesselkonformationen des Cyclohexans
Cyclohexan kann verschiedene Konformationen annehmen, und die stabilste ist die Sesselkonformation. Innerhalb dieser Konformation existieren zwei unterschiedliche Positionen für Substituenten: axial (parallel zur vertikalen Achse des Rings) und äquatorial (in der Ebene des Rings oder annähernd in dieser Ebene).
Stell dir das Cyclohexan wie einen Strandkorb vor, in dem die äquatorialen Positionen den Armlehnen entsprechen, während die axialen Positionen wie die vertikal stehenden Kopfstützen sind. Substituenten präferieren meist die äquatorialen Positionen, weil diese weniger sterische Hinderung verursachen.
Das IMPP fragt besonders gerne nach den Konformationen von Cyclohexan. Du solltest die unterschiedlichen Positionen der Substituenten und deren Präferenzen verstehen.
Ringinversion und 1,3-diaxiale Wechselwirkung
Die 1,3-diaxiale Wechselwirkung tritt auf, wenn Substituenten in axialen Positionen relativ zueinander stehen und sich die Volumen beanspruchenden Gruppen nah beieinander befinden, was energetisch ungünstig ist. Um dies zu vermeiden, erfolgt eine Ringinversion zu einer anderen Sesselkonformation.
Substituenten in axialen Positionen verursachen stärkere 1,3-diaxiale Wechselwirkungen und daher ist die Konformation, bei der die großen Substituenten äquatorial liegen, stabiler.
Andere Cycloalkane
Bei anderen Cycloalkanen wie Cyclopropan oder Cyclooctatetraen können die Konformationsanalysen komplexer werden, da die Ringspannung und mögliche nicht-planare Konformationen wie die Tub- oder Fasskonformation zu beachten sind.
Physikalische Eigenschaften von Alkanen
Siede- und Flammpunkte
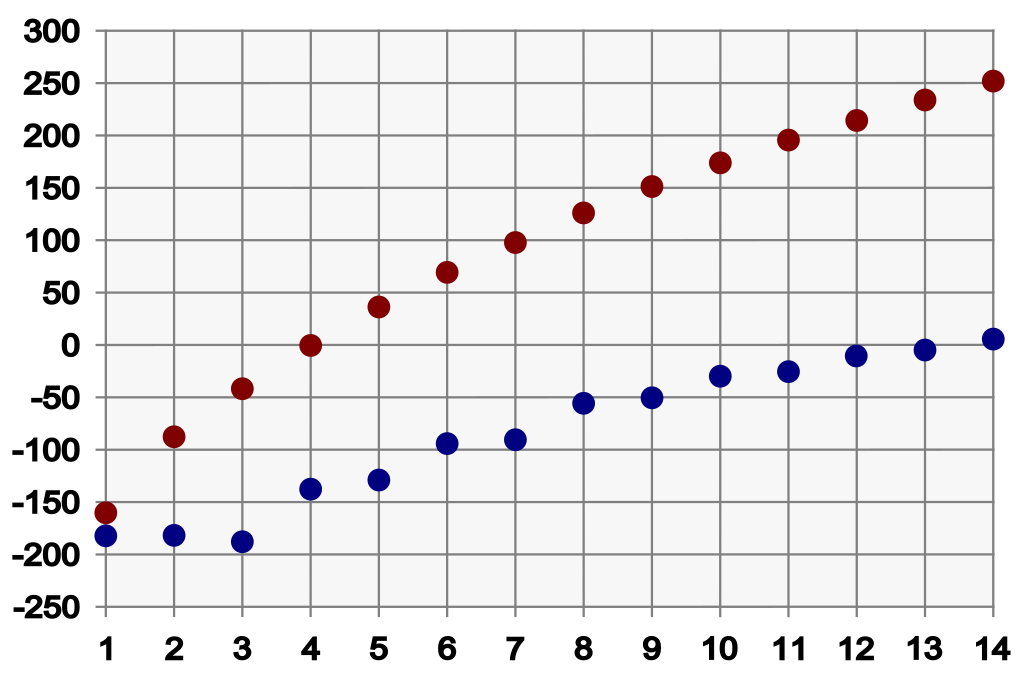
Die Siede- und Flammpunkte von Alkanen hängen von der molekularen Masse und der Kompaktheit der Molekülstruktur ab. Längere und weniger verzweigte Alkane wie n-Hexan haben höhere Siedepunkte, da die Van-der-Waals-Interaktionen mit der Molekülgröße zunehmen. Petrolether, ein Gemisch aus leichten Alkanen, ist aufgrund seiner flüchtigen Komponenten hochentzündlich.
Reaktionen von Alkanen
Radikalische Photochlorierung
Alkane unterziehen sich einer radikalischen Photochlorierung, bei der unter Lichteinwirkung Chlor-Radikale entstehen, die dann mit den Alkanen reagieren. Diese Reaktion läuft in einer radikalischen Kettenreaktion ab, die eine Start-, Wachstums- und Abbruchreaktion beinhaltet. Methan kann bei hohen Alkanüberschüssen bevorzugt monochloriert werden, aber auch mehrfach chlorierte Produkte sind möglich.
Grignard-Reaktion
Grignard-Reagenzien können mit CH-aciden Verbindungen oder Wasser reagieren, um Methan zu bilden. Diese Reaktionen sind wichtig für die Synthese unterschiedlicher organischer Moleküle.
Das IMPP fragt gerne nach den Reaktionsmechanismen der Alkane, einschließlich der Bedingungen, die für spezielle Reaktionen wie Photochlorierung und Grignard-Reaktionen erforderlich sind.
Reaktionen und Stabilität spezieller Strukturen
Cyclopropanringe sind aufgrund ihrer Ringspannung besonders reaktiv und zeigen Reaktivitäten, die den Alkenen ähnlich sind. Wissen um diese Besonderheiten ist essentiell, um die spezielle Chemie der kleineren Cycloalkane verstehen zu können.
Bredt-Regel und spezielle Strukturen
Die Bredt-Regel hilft dabei, die Reaktivität und Stabilität von komplexeren Ringsystemen zu verstehen. Sie besagt, dass Brückenkopfdoppelbindungen in bicyclischen Systemen Spannung erzeugen und somit instabil sind.
Die Bredt-Regel ist ein zentrales Konzept für das Verständnis von Spannung und Stabilität in bicyclischen Verbindungen.
Bedeutung und Anwendung
Alkane und Cycloalkane sind grundlegende Bestandteile von Treibstoffen und Schmierstoffen und finden breite Anwendung in Industrie und Alltag. Methan als einfachstes Alkan ist ein Hauptbestandteil von Erdgas und spielt eine Rolle als Energieträger und in der chemischen Synthese.
Indem du die genannten Konzepte verstehst und dir die spezifischen Reaktionen und Eigenschaften dieser Molekülklassen einprägst, wirst du gut auf Fragen in deiner Prüfung zur organischen Chemie vorbereitet sein.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Allgemeine Strukturformel der Alkane Grafik: Jü, N-Alkanes General Formula V2, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Siedepunkte der Alkane in Abhängigkeit der Kettenlänge Grafik: Aglarech, Alkanschmelzundsiedepunkt2, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
