Halogenverbindungen und Interhalogene
IMPP-Score: 0.8
Halogene und ihre Verbindungen
Halogene sind eine faszinierende Gruppe von Elementen im Periodensystem, besonders durch ihre Fähigkeit, eine vielfältige Palette von Verbindungen zu bilden. Unter diesen Verbindungen finden die Interhalogenverbindungen besondere Beachtung, weil sie ein einzigartiges Verhalten und interessante Strukturen aufweisen.
Was sind Interhalogenverbindungen?
Interhalogenverbindungen bestehen aus zwei verschiedenen Halogenatomen. Hier greifen zwei interessante Halogene ineinander und schaffen etwas Neues, das sich von den typischen Eigenschaften der Einzelhalogene unterscheidet. Wie das IMPP besonders gerne abfragt, solltet ihr euch vor allem die Zusammensetzungen merken: diatomar (XY), tetraatomar (XY\(_4\)), triatomar (XY\(_3\)) oder hexaatomar (XY\(_6\)). Ein Verständnis für diese strukturellen Unterschiede ist entscheidend, um ihre Reaktivität und Chemie zu begreifen.

Warum gibt es bestimmte Interhalogenverbindungen nicht?
Eine wichtige Regel ist, dass kein Halogen mehr andere Halogenatome binden kann, als es Bindungen eingehen kann. Daher existieren keine Verbindungen wie Fis, da Iod nur eine bestimmte Anzahl von Bindungen eingehen kann – und diese Grenze ist durch die Elektronenkonfiguration des Iods definiert. Es ist also besonders wichtig, die möglichen Bindungskombinationen und -grenzen zu kennen.
Strukturelle Besonderheiten
Die Strukturen von Interhalogenverbindungen unterscheiden sich von einfachen Halogenverbindungen. Interhalogene wie ClF3 oder IF5 zeigen geometrische Formen, die nicht symmetrisch sind. Kenntnisse über diese Molekülgeometrien sind nicht nur im Labor, sondern auch bei Examensfragen zentral.
In Interhalogenverbindungen wie ClF, ICl oder IF7 ist es wichtig, die Oxidationszahlen beider Halogene korrekt zu bestimmen. Beachtet, dass das elektronegativere Fluor stets die Oxidationszahl -1 erhält, während das andere Halogen eine positive Oxidationszahl aufweist.
Beispielverbindungen und deren Reaktivität
Typische Beispiele für Interhalogenverbindungen, wie ICl, IBr, ClF, BrF und IF, sind besonders reaktiv. Diese Reaktivität unterscheidet sich signifikant von den einfachen Halogenen und ist eine Schlüsselcharakteristik, die ihr verstehen solltet.
Die Polarität und Oxidationskraft der Halogene
Ein weiterer Schwerpunkt liegt auf der Polarität und den generellen Trends in der Polarität von Halogen-Kohlenstoff-Bindungen. Denkt daran, dass die Polarität mit steigender Elektronegativität des Halogens zunimmt. So ist die C-F-Bindung die polarste, während die Oxidationskraft von Fluor zu Iod abnimmt.
Hydrolysestabilität und typische Reaktionen
Einige Interhalogenverbindungen sind stabil gegenüber Hydrolyse, während andere schnell mit Wasser reagieren. Kenntnisse über die Hydrolysestabilität und die erwarteten Reaktionsprodukte sind essenziell.
Sonstige Besonderheiten
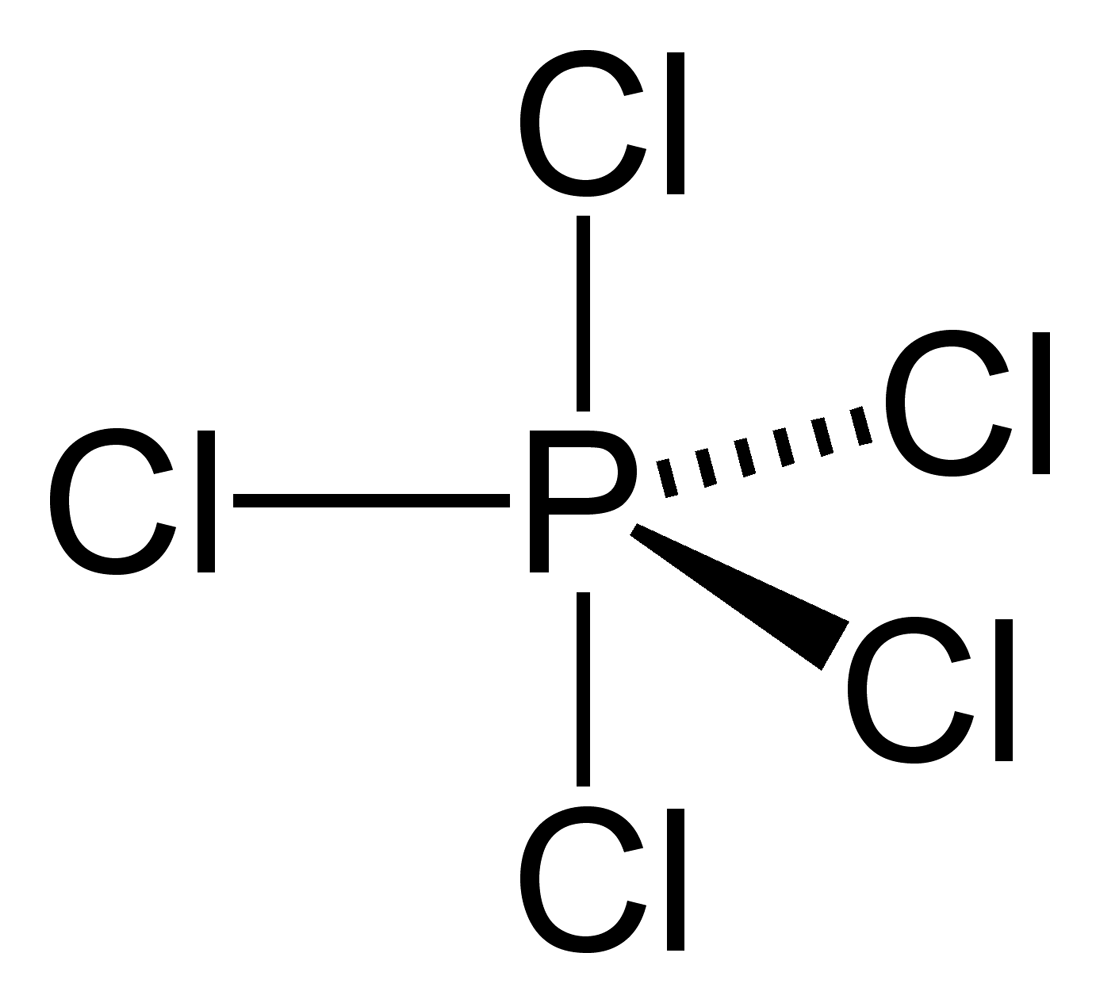
Phosphor bildet in PCl5 im festen Zustand ein Ionengitter aus PCl4\(^+\) und PCl6\(^-\), während PCl5 und PCl3 mit Wasser unterschiedliche Produkte bilden. Diese Unterschiede in der Struktur und Reaktivität sind von großer Bedeutung.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Interhalogenverbindungen Grafik: Autor unbekannt.↩︎
Credits Sturktur von Phosphopentachlorid Grafik: Autor unbekannt., Phosphorus-pentachloride-2D, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
