Verteilungsgleichgewichte
IMPP-Score: 0.5
Verteilungsgleichgewichte und das Nernst’sche Verteilungsgesetz
Verteilungsgleichgewichte spielen eine wesentliche Rolle in der allgemeinen Chemie und finden insbesondere in der Pharmazie wichtige Anwendung. Ein gelöster Stoff kann sich zwischen zwei nicht mischbaren Phasen verteilen, und nach einiger Zeit stellt sich ein Gleichgewicht ein. Dies wird durch das Nernst’sche Verteilungsgesetz beschrieben, das du verstehen musst, um Gleichgewichtsverhältnisse in Systemen mit zwei Phasen berechnen zu können.
Definition des Nernst’schen Verteilungsgesetzes
Das Nernst’sche Verteilungsgesetz definiert das Verteilungsgleichgewicht eines löslichen Stoffes zwischen zwei nicht mischbaren Lösungsmitteln. Hier einmal am Beispiel von Öl und Wasser illustriert:
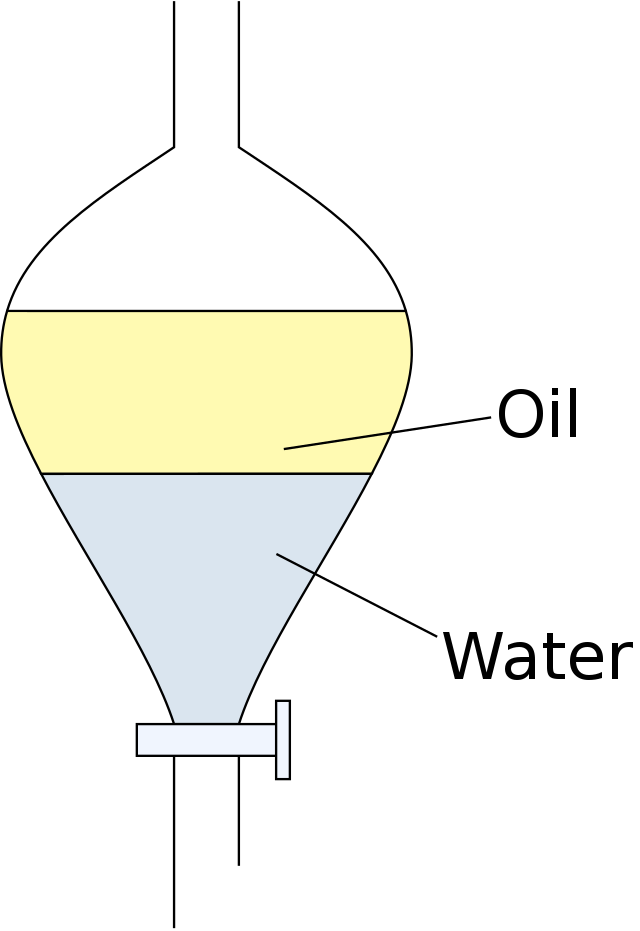
Wenn sich das Gleichgewicht eingestellt hat, ist das Verhältnis der Konzentrationen des gelösten Stoffes in den beiden Phasen konstant. Dieses Verhältnis wird als Verteilungskoeffizient \(K\) bezeichnet und ist gegeben durch:
\[ K = \frac{c_{\text{Phase 1}}}{c_{\text{Phase 2}}} \]
wobei \(c_{\text{Phase 1}}\) und \(c_{\text{Phase 2}}\) die Konzentrationen des Stoffes in den jeweiligen Phasen, etwa Dichlormethan und Wasser, sind. Es ist wichtig zu wissen, dass \(K\) nur dann gültig ist, wenn der gelöste Stoff in beiden Phasen im gleichen chemischen Zustand vorliegt.
Beispiel für die Berechnung des Verteilungskoeffizienten
Angenommen, ein gelöster Stoff hat eine Konzentration von \(1\, \text{mg/ml}\) in Dichlormethan (\(c_{\text{Dichlormethan}}\)) und eine Konzentration von \(0,1\, \text{mg/ml}\) in Wasser (\(c_{\text{Wasser}}\)), dann wäre der Verteilungskoeffizient \(K\) für dieses System:
\[ K = \frac{c_{\text{Dichlormethan}}}{c_{\text{Wasser}}} = \frac{1 \, \text{mg/ml}}{0,1 \, \text{mg/ml}} = 10 \]
Das bedeutet, der Stoff ist in Dichlormethan zehnmal konzentrierter als in Wasser, wenn das Verteilungsgleichgewicht erreicht ist.
Das IMPP fragt besonders gerne nach dem Verständnis und der Berechnung des Verteilungskoeffizienten, also stelle sicher, dass du diese Berechnungen beherrschst.
Einfluss der Temperatur auf den Verteilungskoeffizienten
Die Temperatur ist ein wichtiger Faktor, der den Verteilungskoeffizienten beeinflussen kann, denn sie verändert sowohl die Löslichkeit als auch die chemischen Eigenschaften der Substanzen. In der Regel wird davon ausgegangen, dass die Löslichkeit vieler Stoffe mit steigender Temperatur zunimmt, was dazu führt, dass der Verteilungskoeffizient mit zunehmender Temperatur abnimmt. Dies ist jedoch stark vom System und den individuellen Eigenschaften der Substanzen abhängig.
Mehrfaches Teilausschütteln
Bei der Extraktion eines Stoffes aus einer Phase in eine andere zeigt sich, dass mehrfaches Teilausschütteln mit kleineren Volumina des Lösungsmittels effektiver ist als ein einmaliges Ausschütteln mit einem großen Volumen. Dies liegt daran, dass nach jeder Extraktion die Treibkraft für die Übertragung des Stoffes in die zweite Phase aufgrund des verringerten Konzentrationsunterschieds abnimmt. Daher ist die Effizienz der Extraktion bei wiederholter Anwendung des Verteilungsgesetzes wesentlich höher.
Pharmazeutische Bedeutung des Octanol-Wasser-Verteilungskoeffizienten
In der Pharmazie ist der Octanol-Wasser-Verteilungskoeffizient ein zentrales Maß für das Verständnis der Lipophilie von Substanzen. Dieser Koeffizient ist ein Prädiktor für die Fähigkeit einer Substanz, durch biologische Membranen zu diffundieren. Ein hoher Koeffizient deutet auf eine gute Lipidlöslichkeit hin, was wichtig für die Absorption und Bioverfügbarkeit von Wirkstoffen sein kann.
Praktische Anwendung von Verteilungskoeffizienten
In der Praxis kannst du Verteilungsgleichgewichte nutzen, um zu berechnen, wie viel von einem Stoff nach mehrfacher Extraktion in einer Phase verbleibt, oder um die Verteilung eines Stoffes in einem Zweiphasensystem wie Ether-Wasser zu ermitteln. Zum Beispiel, wenn du die Ausgangskonzentration eines Stoffes und das Volumen der Phasen kennst, kannst du die Menge des Stoffes berechnen, die nach dem Erreichen des Gleichgewichts in jeder Phase vorhanden ist.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Zwei nicht mischbare Lösungsmittel Grafik: Anonymous. Borb assumed (based on copyright claims)., SeparatoryFunnel, CC BY-SA 3.0↩︎