Flüssigkeiten
IMPP-Score: 0.4
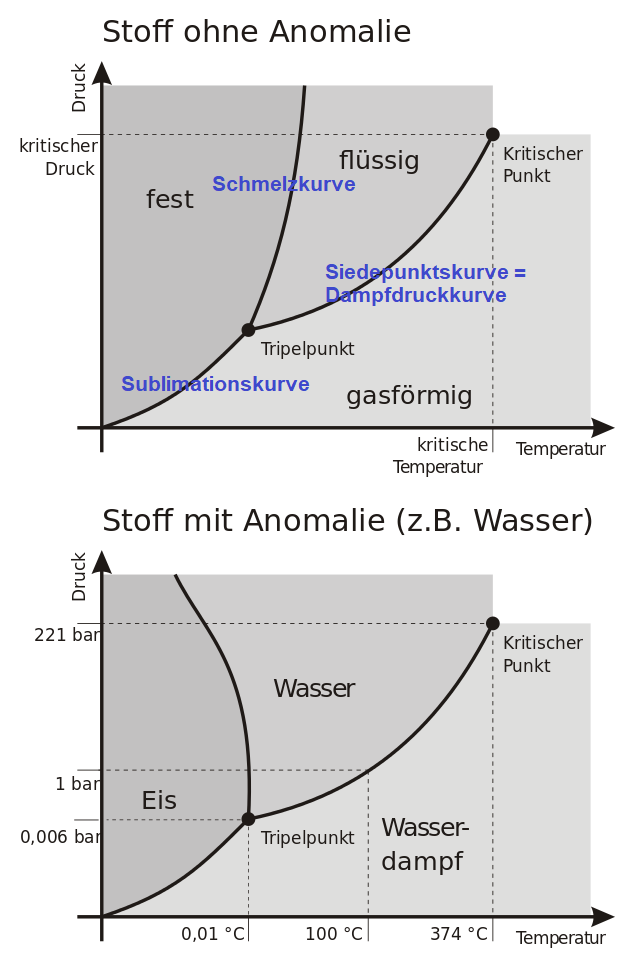
Dampfdruckkurve und Phasendiagramme
Der Dampfdruck einer Flüssigkeit ist ein Maß für die Tendenz ihrer Moleküle, in die Gasphase überzugehen. Temperaturen und Drücke, unter denen Flüssigkeiten und Gase im Gleichgewicht stehen, werden durch die Dampfdruckkurve in einem Phasendiagramm beschrieben. Diese Kurve verläuft vom Tripelpunkt, an dem alle drei Phasen im Gleichgewicht sind, bis zum kritischen Punkt. Besonders wichtig ist hier das Verständnis, dass mit steigender Temperatur der Dampfdruck einer Flüssigkeit zunimmt.
Für eine ideale Lösung zeigt die Raoult’sche Regel, dass der Dampfdruck des Lösungsmittels proportional zum Molenbruch des Lösungsmittels in der Lösung ist. Das bedeutet für Lösungen mit nichtflüchtigen Substanzen, dass ihr Dampfdruck niedriger ist als der des reinen Lösungsmittels. Das ist essentiell für das Verständnis von Siedepunkterhöhungen und Gefrierpunkterniedrigungen in Lösungen.
Das IMPP fragt besonders gerne nach der Beziehung zwischen Dampfdruck und Temperatur und wie diese im Phasendiagramm dargestellt wird.
Einfluss von Druck und Temperatur
Du weißt bereits, dass Druck und Temperatur eine entscheidende Rolle bei den Phasenübergängen spielen. So führt beispielsweise ein Anstieg des Drucks dazu, dass die Schmelztemperatur von Eis sinkt. Somit kann Eis unter Druck zu Wasser schmelzen. Diese Kenntnisse sind nicht nur theoretisch, sondern auch praktisch sehr wichtig, zum Beispiel beim Verständnis von Gletscherbewegungen.
Bei höherem Druck sinkt die Schmelztemperatur von Eis.
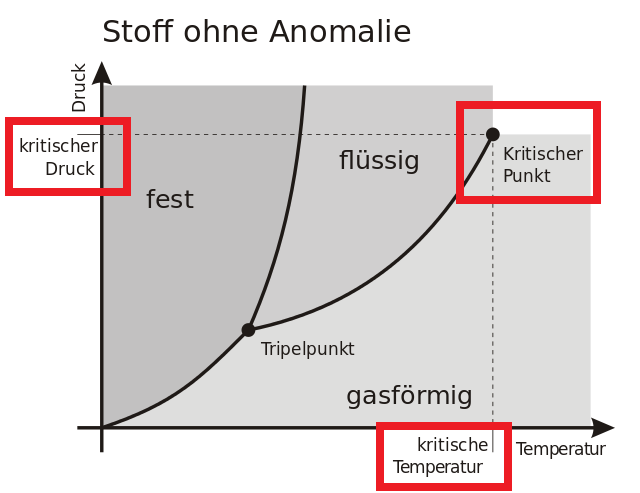
Kritischer Punkt und Überkritische Fluide
Ein besonders interessanter Punkt im Phasendiagramm ist der kritische Punkt. Oberhalb der kritischen Temperatur und des kritischen Drucks gibt es keinen Unterschied mehr zwischen der flüssigen und der gasförmigen Phase, und Wasser kann beispielsweise unabhängig vom Druck nicht mehr verflüssigt werden. Dies hat nicht nur theoretische Bedeutung, sondern ist auch für die Industrie bei der Verwendung von überkritischen Fluiden als Lösungsmittel relevant.
Molare Schmelz- und Kristallisationsenthalpie
Die molare Schmelzenthalpie gibt dir die Menge an Energie an, die benötigt wird, um ein Mol eines festen Stoffes zu schmelzen. Im Gegenzug dazu steht die molare Kristallisationsenthalpie, die die beim Erstarren abgegebene Wärme quantifiziert. Wichtig zu wissen ist, dass diese beiden Werte entgegengesetzt gleich sind.
Eigenschaften von Wasser
Wasser ist in vielen Aspekten ein besonderes Molekül, insbesondere durch seine Dichte von circa 1 g/cm³ bei Normalbedingungen. Die relative Dielektrizitätszahl von Wasser ist außergewöhnlich hoch, was Wasser zu einem exzellenten Lösungsmittel für polare Substanzen und Ionische Verbindungen macht. Hiermit sollst du verstehen, warum Salze in Wasser im Vergleich zu anderen Lösungsmitteln wie n-Hexan oder Diethylether besser löslich sind.
Die relative Dielektrizitätszahl beeinflusst die Löslichkeit von ionischen Verbindungen und polaren Substanzen.
Durch den Vergleich der physikalischen Eigenschaften von Wasser mit denen anderer Lösungsmittel und deren Dielektrizitätszahlen wird der Kontrast und der Einfluss auf das Lösevermögen deutlich.
In einem gut verständlichen Format sind diese Konzepte nicht nur für die Vorbereitung auf Prüfungen wie die des IMPP relevant, sondern auch für das tiefere Verständnis chemischer und physikalischer Prozesse insgesamt. Eindrückliche Diagramme und Schaubilder zu diesen Themen werden dir dabei helfen, die materiellen Eigenschaften und das Verhalten von Flüssigkeiten besser zu verstehen und zu visualisieren.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Phasendiagramme mit und ohne Anomalie Grafik: de:Benutzer:JoWi, Phasendiagramme, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Kritischer Punkt Grafik: de:Benutzer:JoWi, Phasendiagramme, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
