Sauerstoffsäuren des Stickstoffs
IMPP-Score: 1.2
Sauerstoffsäuren des Stickstoffs und deren Salze
Die Stickstoffgruppe beinhaltet eine Vielzahl von Verbindungen, die entscheidend für chemische Reaktionen aller Art sind. Insbesondere wollen wir uns auf die Sauerstoffsäuren des Stickstoffs fokussieren – ein Thema, das häufig vom IMPP abgefragt wird.
Struktur und Stöchiometrie von Nitrat und Nitrit
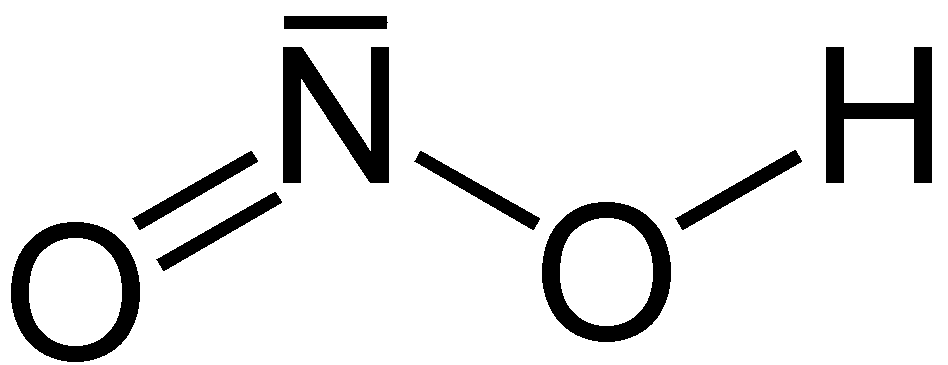
Beginnen wir mit der Struktur von Stickstoffsäuren wie Salpetersäure (\(\text{HNO}_3\)) und salpetriger Säure (\(\text{HNO}_2\)). Diese sind in den folgenden Grafiken dargestellt:
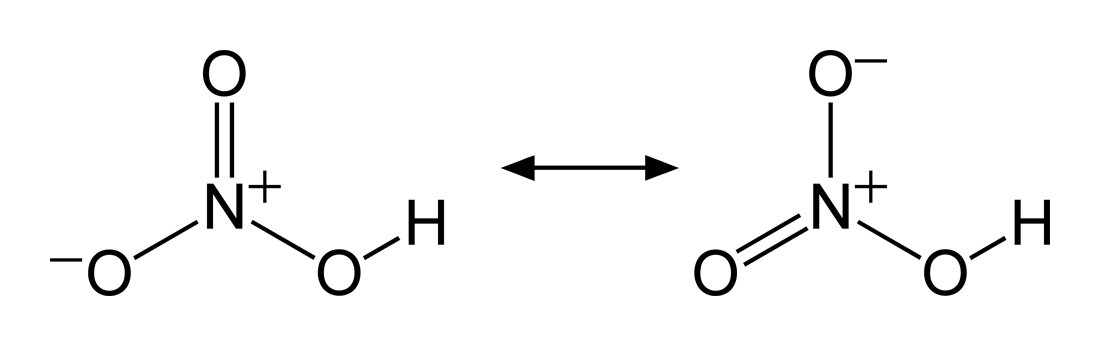
Die Oxidationsstufen des Stickstoffs variieren je nach Säure. In Salpetersäure liegt Stickstoff in der Oxidationsstufe +5 vor, der höchsten Oxidationsstufe in diesen Verbindungen. Dies bedeutet, dass das Stickstoffatom in \(\text{HNO}_3\) fünf Elektronen abgibt, was durch vier Bindungen zu Sauerstoff (drei mit Doppelbindungscharakter und eine mit Einfachbindungscharakter zum Hydroxid-Ion) repräsentiert wird.
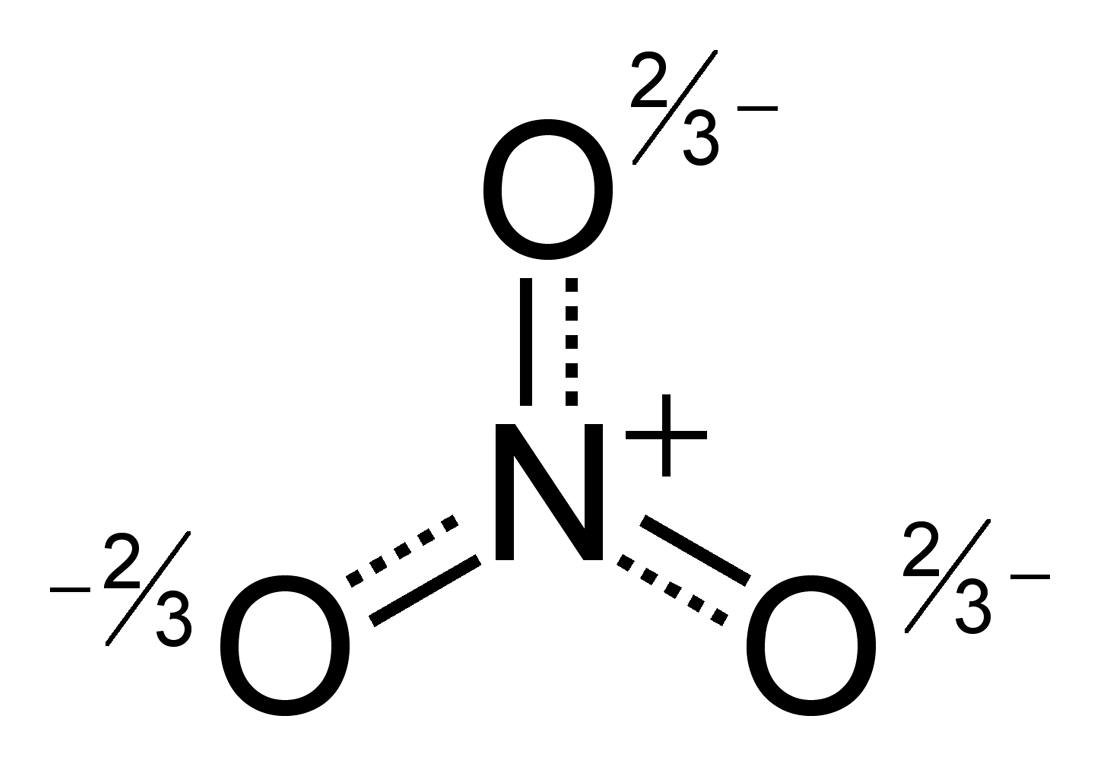
Das Nitrat-Ion (\(\text{NO}_3^-\)) ist planar und symmetrisch, während das Nitrit-Ion (\(\text{NO}_2^-\)) eine gewinkelte Struktur mit einem nichtbindenden Elektronenpaar am Stickstoff aufweist.
Die Salze von HNO3 sind Nitrate und die von HNO2 Nitrite. Sie enthalten die jeweiligen Anionen dieser Säuren. Nitrate haben das Nitrat-Ion (\(\text{NO}_3^-\)) als Anion, das eine trigonal planare Struktur aufweist, während Nitrite das Nitrit-Ion (\(\text{NO}_2^-\)) beinhalten, das eine gewinkelte Struktur hat. Diese Strukturunterschiede leiten sich von der Anwesenheit eines nichtbindenden Elektronenpaars am Stickstoff im Nitrit-Ion ab.
Herstellung und Stabilität
Die Herstellung von Salpetersäure erfolgt über das Ostwald-Verfahren, bei dem aus Ammoniak über die Zwischenstationen NO und \(\text{NO}_2\) letztlich \(\text{HNO}_3\) synthetisiert wird.
Salpetrige Säure hingegen ist instabil und existiert nicht in reiner Form; sie kann nur in situ aus Natriumnitrit (\(\text{NaNO}_2\)) erzeugt werden, was ihre Untersuchung und Verwendung in chemischen Synthesen komplex macht.
Thermische Eigenschaften
Die thermischen Eigenschaften von stickstoffhaltigen Verbindungen wie dem Ammoniumnitrat sind wichtig, da diese Stoffe bei Erwärmung zu einer energischen Zersetzung neigen. Dies unterstreicht die Bedeutung von Sicherheitshinweisen im Umgang mit diesen Chemikalien.
Salpetersäure als Oxidationsmittel
Salpetersäure ist ein starkes Oxidationsmittel. Sie reagiert mit vielen Metallen unter Bildung von NOx-Gasen; diese Reaktionen sind ein zentraler Aspekt bei der Behandlung von Salpetersäure im Laboralltag.
Salpetersäure löst als starkes Oxidationsmittel unedle Metalle und ist für die Nitrierung von Aromaten durch Bildung von Nitronium-Ionen (\(\text{NO}_2^+\)) entscheidend.
Reaktionen im Sauren Milieu
Sowohl Salpetersäure als auch salpetrige Säure reagieren im sauren Milieu:
- Salpetersäure kann Elektrophile wie das Nitronium-Ion für Nitrierungsreaktionen bereitstellen.
- Salpetrige Säure ist in der Lage, Diazonium-Ionen durch Reaktion mit aromatischen Aminen zu bilden, die in Folgereaktionen für synthetische Zwecke genutzt werden können.
Reaktionswege von Nitrat und Nitrit
Nitrat- und Nitrit-Ionen weisen verschiedene Reaktionswege auf:
- Nitrite können zum Beispiel mit Harnstoff reagieren und dabei Stickstoffgas freisetzen.
- Nitrate lassen sich zu Nitrit reduzieren oder durch Oxidationsmittel wie Wasserstoffperoxid oxidieren.
Säurestärke und pKs-Wert
Die Säurestärke von Salpetersäure ist höher als die von salpetriger Säure. Dies spiegelt sich in den jeweiligen pKs-Werten wider, die die Bereitschaft einer Säure beschreiben, ein Proton abzugeben.
Die Säurestärke korreliert mit der Reaktivität gegenüber Metallen. Salpetersäure ist stärker als salpetrige Säure und hat einen negativen pKs-Wert, was sie zu einer der stärksten bekannten Säuren macht.
Brønsted-Theorie und Pseudohalogenide
Nach der Brønsted-Theorie sind Säuren Protonendonoren. Diese Definition wird für das Verständnis der Reaktionen von Säuren und ihren Salzen benötigt. Thiocyanate gehören zu den Pseudohalogeniden und weisen ähnliche Reaktivitäten wie Halogenide auf, obwohl sie eine andere chemische Struktur besitzen.
Sicherheit und Umweltaspekte
Sicherheitshinweise sind für den Umgang mit Säuren und deren Salzen von höchster Wichtigkeit, insbesondere wegen der oxidierenden und korrosiven Eigenschaften von Salpetersäure. Ebenso sollte man die Umweltauswirkungen dieser Chemikalien berücksichtigen.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Mesomere Grenzstrukturen der Salpetersäure Grafik: Benjah-bmm27, Nitric-acid-resonance-A, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Struktur der Salpetrigen Säure Grafik: Eschenmoser, Salpetrige Säure, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits Struktur von Nitrat Grafik: Benjah-bmm27, Nitrate-ion-resonance-hybrid-2D, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎