Zwischenmolekulare Bindungskräfte
IMPP-Score: 2.3
Zwischenmolekulare Kräfte und ihre Auswirkungen
Zwischenmolekulare Kräfte spielen eine zentrale Rolle beim Verständnis chemischer Eigenschaften und Reaktionen. Sie bestimmen unter anderem, wie Moleküle zusammenkommen und interagieren, was unmittelbare Auswirkungen auf Schmelz- und Siedepunkte, Löslichkeit, die Struktur von Molekülen und Gittern und vieles mehr hat. Bevor wir uns in die Details der unterschiedlichen zwischenmolekularen Kräfte begeben, ist es wichtig, zu verstehen, was sie von intramolekularen Kräften unterscheidet. Intramolekulare Kräfte halten ein Molekül zusammen (z.B. kovalente Bindungen), während zwischenmolekulare Kräfte Wechselwirkungen zwischen getrennten Molekülen beschreiben.
Wasserstoffbrückenbindungen
Wasserstoffbrückenbindungen sind eine der stärksten Formen zwischenmolekularer Kräfte. Sie treten auf, wenn ein Wasserstoffatom, das bereits an ein stark elektronegatives Atom wie Fluor, Sauerstoff oder Stickstoff gebunden ist, eine Anziehung zu einem freien Elektronenpaar an einem anderen elektronegativen Atom ausübt.
Die Bedeutung von Wasserstoffbrücken für die Stabilität von Biomolekülen wie Proteinen und DNA darf nicht unterschätzt werden. Es ist auch entscheidend, sich die spezifischen Bedingungen für das Auftreten von Wasserstoffbrücken zu merken, da sie oft Prüfungsgegenstand sind.
In der Praxis sehen wir die Bedeutung von Wasserstoffbrücken beim Vergleich der Siedepunkte von Wasser und Alkoholen mit ähnlichen Molekülen ohne diese Wechselwirkungen. Wasser (H2O) hat beispielsweise einen unerwartet hohen Siedepunkt, da die starken Wasserstoffbrücken zwischen den Wassermolekülen viel Energie zur Überwindung benötigen.
Das IMPP fragt besonders gerne nach Beispielen zur Illustration der Auswirkungen von Wasserstoffbrückenbindungen auf Siedepunkte. Die H-Brücken führen dazu, dass Substanzen wie HF, NH3 und H2O überraschend hohe Siedepunkte aufweisen, die ohne diese Art von Wechselwirkungen viel niedriger liegen würden.
Van der Waals-Kräfte
Dispersionskräfte
Dispersionskräfte, auch London-Kräfte genannt, sind die schwächsten zwischenmolekularen Kräfte und wirken zwischen allen Atomen und Molekülen, auch solchen ohne permanentes Dipolmoment. Sie entstehen durch zufällige Schwankungen in der Elektronenverteilung, die temporäre Dipole erzeugen können. Diese Kräfte nehmen mit der Molekülgröße und Polarisierbarkeit zu, was erklärt, warum größere Moleküle höhere Siedepunkte haben können als kleinere.
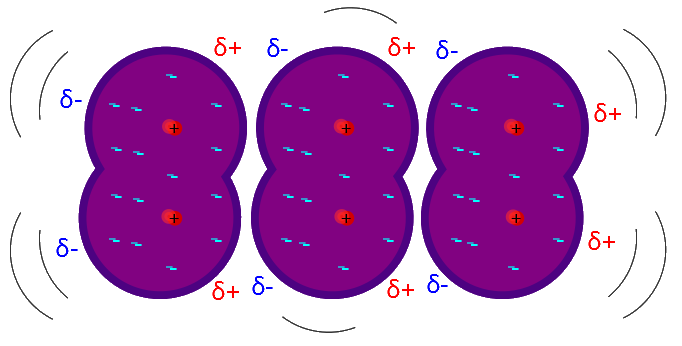
Im Examen könnte das IMPP nach dem Einfluss der Molekülgröße auf das Ausmaß der Dispersionskräfte fragen. Es ist nützlich, Beispiele wie Edelgase oder linear aufgebaute Alkane im Kopf zu haben, um diesen Punkt zu verdeutlichen.
In unpolaren Molekülen wie langkettigen Alkanen dominieren Dispersionskräfte. Diese wirken zwischen allen Atomen und Molekülen und resultieren aus kurzzeitigen Dipolen, die durch zufällige Elektronenbewegungen entstehen. Ihre Stärke hängt von der Polarisierbarkeit der Moleküle ab und führt bei längeren Ketten zu höheren Schmelzpunkten.
Das IMPP prüft oft das Verständnis darüber, wie Dispersionskräfte die physikalischen Eigenschaften beeinflussen, vor allem bei unpolaren Molekülen.
Elektrostatische Wechselwirkungen
Ion-Dipol- und Dipol-Dipol-Kräfte treten auf, wenn Ionen oder Moleküle mit permanenten Dipolmomenten vorhanden sind. Das Ausmaß dieser Kräfte hängt von der Stärke der permanenten Dipole ab. So haben Substanzen mit höherem Dipolmoment oftmals höhere Siede- und Schmelzpunkte und eine bessere Löslichkeit in polaren Lösungsmitteln.
Wir sehen die Bedeutung dieser Kräfte bei der Hydratisierung von Ionen in Lösung: Wassermoleküle mit ihrem relativ hohen Dipolmoment lagern sich um Ionen herum und stabilisieren sie in der Lösung durch ion-dipol Wechselwirkungen. Diese Wechselwirkungen sind auch verantwortlich für die Struktur von Ionengittern, wie im klassischen Beispiel von Natriumchlorid (NaCl).
Aggregatzustände und Übergänge
Zwischenmolekulare Kräfte helfen ebenso dabei, die Aggregatzustände und deren Übergänge zu verstehen. Bei PCl5 zum Beispiel erklären diese Kräfte, warum die Substanz unter bestimmten Bedingungen als Flüssigkeit vorliegt. Dies zeigt die grundlegende Bedeutung dieser Kräfte bei der Erklärung von Phänomenen, die über die Molekülstruktur hinausgehen.
Zwischenmolekulare Kräfte in biologischen Systemen
Speziell bei biologischen Molekülen wie Proteinen sind zwischenmolekulare Wechselwirkungen, insbesondere Wasserstoffbrückenbindungen, für die korrekte Faltung und Funktionalität von essenzieller Bedeutung. Jede Veränderung in den Wechselwirkungen kann weitreichende Konsequenzen für die Struktur und somit die Funktion der Proteine haben.
Für das IMPP ist es wichtig, dass ihr versteht, wie zwischenmolekulare Kräfte auf biologische Moleküle einwirken, speziell im Zusammenhang mit der Struktur und Funktion von Proteinen.
Zusammenfassend spielen zwischenmolekulare Bindungskräfte eine zentrale Rolle beim Verständnis der physikalischen Eigenschaften von Substanzen. Die unterschiedlichen Kräfte wie Wasserstoffbrückenbindungen, Dispersionskräfte und Dipol-Dipol-Wechselwirkungen sowie der Kontext, in dem sie auftreten, beeinflussen nicht nur die chemischen und physikalischen Verhaltensweisen von Molekülen, sondern sind auch für die Komplexität biologischer Systeme verantwortlich.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Wasserstoffbrueckenbindungen Grafik: User Qwerter at Czech wikipedia: Qwerter. Transferred from cs.wikipedia to Commons by sevela.p. Translated to english by by Michal Maňas (User:snek01). Vectorized by Magasjukur2, 3D model hydrogen bonds in water, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎
Credits London Dispersionskräfte Grafik: Riccardo Rovinetti, Forze di London, CC BY-SA 3.0↩︎
