Phasensysteme
IMPP-Score: 0.9
Was ist eine Phase?
Eine Phase ist ein Bereich in einem Stoff- oder Materialsystem, der in seinen physikalischen Eigenschaften, wie Dichte, Magnetisierung oder Index der Lichtbrechung, sowie seiner Zusammensetzung homogen ist. Die Begrenzung einer Phase gegenüber einer anderen Phase bildet eine Trennfläche, die sogenannte Phasengrenzfläche.

In dem Bild sehen wir alle drei Phasen von Wasser auf einmal: Fest, Flüssig und Gasförmig.
Denke daran, dass Phasen homogen sind. In einem homogenen Phasensystem wie einer Salzlösung ist die Zusammensetzung überall gleich. Im Gegensatz dazu ist bei einem Sand-Wasser-Gemisch jede Komponente eine eigene Phase und es bildet ein heterogenes Phasensystem.
Homogene und heterogene Phasensysteme
Homogene Phasensysteme enthalten nur eine einzige Phase, wie das o.g. Beispiel der Salzlösung. Heterogene Phasensysteme hingegen enthalten zwei oder mehr Phasen. Der Sand am Boden eines Wasserglases wäre demnach eine Phase (fest), das darüberstehende Wasser eine zweite Phase (flüssig).
Phasengleichgewichte
Im Kontext von Phasensystemen ist auch die Betrachtung von Phasengleichgewichten wichtig. Ein dynamisches Gleichgewicht bedeutet, dass zwischen verschiedenen Phasen eines Systems Austauschprozesse stattfinden, ohne dass sich die Mengen der Phasen langfristig ändern. Zum Beispiel verdunstet Wasser in einem geschlossenen Behälter, aber es kondensiert auch an den Wänden gleichzeitig so viel, wie es verdunstet – ein Gleichgewicht.
Verstehe kolligative Eigenschaften wie die Siedepunktserhöhung und Gefrierpunktserniedrigung im Zusammenhang mit gelösten Stoffen als Resultat der veränderten Phasengleichgewichte.
Zustandsdiagramme und charakteristische Punkte
Zustandsdiagramme illustrieren, wie verschiedene Phasen eines Stoffes unter verschiedenen Bedingungen von Temperatur und Druck koexistieren.
- Phasengrenzen: Diese Linien auf dem Zustandsdiagramm kennzeichnen die Bedingungen, bei denen zwei Phasen eines Stoffes im Gleichgewicht sind.
- Tripelpunkt: Hier treffen sich die drei Aggregatzustände (fest, flüssig, gasförmig) eines Stoffes bei einem spezifischen Druck und einer spezifischen Temperatur.
- Kritischer Punkt: Dies ist der Punkt, ab dem die flüssige und die gasförmige Phase eines Stoffes nicht mehr unterschieden werden können, da die Eigenschaften dieser beiden Phasen gleich werden. Jenseits des kritischen Punktes spricht man von einem überkritischen Fluid.
Das Phasendiagramm von Wasser ist besonders interessant, weil es u.a. eine negative Steigung der Schmelzdruckkurve aufweist, welche zeigt, dass Eis unter Druck bei einer niedrigeren Temperatur schmilzt.
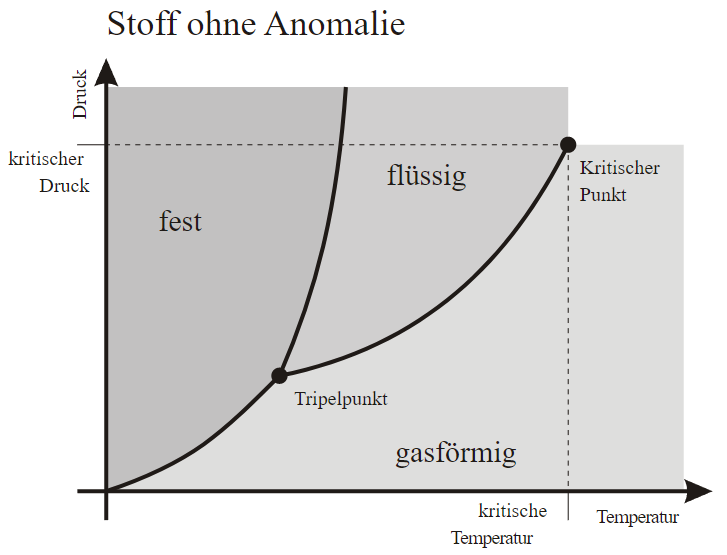
Im Bild gezeigt ist ein Beispiel für ein Phasendiagramm. Besonders sollte man sich die charakteristischen Punkte des Diagramms anschauen.
Azeotrope Gemische
Ein spezielles Thema im Bereich der Phasensysteme sind azeotrope Gemische. Das sind Mischungen, die bei einer bestimmten Zusammensetzung einen konstanten Siedepunkt haben und deren Komponenten aufgrund des gleichen Verhältnisses von Dampf zu Flüssigkeit nicht durch einfache Destillation getrennt werden können. Ein praktisches Beispiel ist das Gemisch aus Wasser und Ethanol, das als Brennspiritus bekannt ist.
Bedenke, dass azeotrope Gemische spezielle Maßnahmen erfordern, um getrennt zu werden, wie beispielsweise die Verwendung von Wasserabscheidern, die basierend auf Dichteunterschieden arbeiten.
Energetische Veränderungen bei Phasenübergängen
Die Diskussion über energetische Veränderungen bei Phasenübergängen, wie dem Lösen von Salzen, führt zum Konzept der Gitterenergie, der Hydratationsenthalpie und dem Löslichkeitsprodukt. Beim Lösungsprozess muss das Ionengitter des Salzes aufgebrochen werden (Gitterenthalpie), und die Ionen werden von Wassermolekülen umgeben (Hydratationsenthalpie). Diese Konzepte wurden bereits zuvor besprochen.
Anwendung und Relevanz im Alltag und der Industrie
Phasensysteme finden im Alltag und in industriellen Prozessen vielfach Anwendung. Denke dabei an das Gefrieren und Schmelzen von Lebensmitteln bis hin zur Trennung von chemischen Gemischen in der pharmazeutischen Industrie durch Destillationsprozesse.
Ein praktisches Beispiel für Phasensysteme sind Meerwasserentsalzungsanlagen, bei denen das Phasengleichgewicht genutzt wird, um Salzwasser zu destillieren und reines Wasser zu gewinnen.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Die drei Phasen des Wassers Grafik: Anonymous. Deglr6328~commonswiki assumed (based on copyright claims). here., Argon ice 1, CC BY-SA 3.0↩︎
Credits Phasendiagramm Grafik: de:Benutzer:JoWi, Phasendiagramme, als gemeinfrei gekennzeichnet, Details auf Wikimedia Commons↩︎