Halogenwasserstoffe und Halogenide
IMPP-Score: 1.2
Struktur, Eigenschaften und Reaktivität von Halogenwasserstoffen und Halogeniden
Struktur von Halogenwasserstoffmolekülen
Halogenwasserstoffe entstehen durch die kovalente Bindung eines Halogenatoms mit einem Wasserstoffatom. Diese Bindungsenergie nimmt bei Halogenwasserstoffen von HF bis HI ab. Machen wir uns das am Beispiel von Chlorwasserstoff (HCl) klar, der aus der Reaktion von Natriumchlorid (NaCl) mit Schwefelsäure (H2SO4) hergestellt werden kann:
\[ \text{NaCl}_{(\text{s})} + \text{H2SO4}_{(\text{l})} \rightarrow \text{HCl}_{(\text{g})} + \text{NaHSO4}_{(\text{s})} \]
Die Bindungsenergie ist ein Maß dafür, wie stark die Atome aneinander gebunden sind. Eine hohe Bindungsenergie bedeutet eine festere Bindung und umgekehrt. Die Elektronegativitätsdifferenz zwischen Halogen und Wasserstoff beeinflusst die Polarität der Bindung und damit die Reaktivität der Verbindung.
Allgemeine Beziehungen
Die allgemeinen Beziehungen innerhalb der Gruppe der Halogenwasserstoffe sind in der unten stehenden Grafik dargestellt. Die wichtigsten Aspekte werden noch einmal weiter unten in eigenen Abschnitten aufgegriffen.
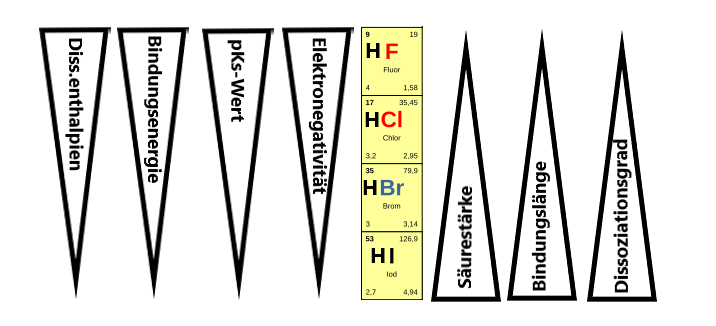
Aggregatzustände und physikalische Eigenschaften
Bei Raumtemperatur sind einige Halogenwasserstoffe wie Chlorwasserstoff gasförmig, während andere, wie Halogenide mit größeren Halogenen oder Alkalimetallen, fest sein können. Aufgrund von Wasserstoffbrückenbindungen hat Fluorwasserstoff (HF) einen unerwartet hohen Siedepunkt:
- HCl: gasförmig bei Raumtemperatur (-85 °C Siedepunkt)
- HF: flüssig bei Raumtemperatur (19,5 °C Siedepunkt)
HF bildet Wasserstoffbrücken aus, was zu einem hohen Siedepunkt und ungewöhnlichen Eigenschaften wie der Unlöslichkeit in Wasser und der Nichtangriffsfähigkeit auf Gold und Platin führt.
Säurestärke und Reaktivität
Die Säurestärke eines Halogenwasserstoffs nimmt von HF zu HI zu, was auf die geringere Bindungsenergie und die leichtere Abspaltbarkeit des Protons bei den größeren Halogenen zurückzuführen ist. Die Stärke von Halogenwasserstoffsäuren ist also eine Funktion der Bindungsenthalpie und der Größe des Halogenatoms. Der pKs-Wert hilft uns, diese Säurestärke quantitativ zu beschreiben. Für Fluorwasserstoff beträgt dieser 3,2, für Iodwasserstoff hingegen -9,3.
Oxidationszahlen und chemische Reaktionen
Bei Chloridionen ist die Oxidationszahl allgemein -1, was mit der Regelmäßigkeit zu tun hat, dass Wasserstoff üblicherweise die Oxidationszahl +1 hat, außer in Verbindungen mit Metallen. Diese Oxidationszahlen spielen in elektrochemischen Reaktionen eine Schlüsselrolle, wie bei der Elektrolyse von NaCl-Lösungen, wo Chlor an der Anode entsteht und Wasserstoffmoleküle an der Kathode.
Verstehe die Oxidationszahlen, da das IMPP gerne nach Reaktionen fragt, die auf Oxidationszahlen beruhen.
Fällungsreaktionen und Löslichkeitsprodukt
Die Rolle von Chloridionen in Fällungsreaktionen, wie etwa bei der Bildung von Silberchlorid, beruht auf der Überschreitung des Löslichkeitsprodukts. Das Hinzufügen von NaCl zu einer Lösung mit Silberionen führt zu einer Fällung von AgCl.
Elektrochemische Aspekte
Elementares Fluor wird durch Elektrolyse eines Gemisches aus Fluorwasserstoff (HF) und Kaliumfluorid (KF) hergestellt. Wegen des hohen Standardpotentials von Fluorid ist dies ein spezialisiertes Verfahren und unterscheidet sich von der Standard-Elektrolyse, die für andere Stoffe verwendet wird.
Reaktionen von Iod und dessen Besonderheiten
Iod zeigt sehr spezifische Reaktionen wie die Synproportionierung in alkalischer Lösung. Während die Stabilität der Halogenwasserstoffe von oben nach unten im Periodensystem abnimmt aufgrund schwächerer Bindungen zwischen Wasserstoff und dem jeweiligen Halogen, disproportioniert Iod in alkalischer Lösung nicht, sondern bildet durch die Reaktion mit Iodid elementares Iod.
Sicherheitshinweise
Im Umgang mit Halogenwasserstoffen und Halogeniden ist größte Vorsicht geboten, insbesondere aufgrund deren korrosiver Eigenschaften. Bei der Handhabung dieser Stoffe müssen immer geeignete Schutzausrüstungen wie Handschuhe und Schutzbrillen verwendet werden.
Zusammenfassung
Feedback
Melde uns Fehler und Verbesserungsvorschläge zur aktuellen Seite über dieses Formular. Vielen Dank ❤️
Footnotes
Credits Beziehungen innerhalb der Gruppe der Halogenwasserstoffe Grafik: Mrmw, Periodensystem newdraft, bearbeitet von MK, CC0 1.0↩︎
Credits Siedetemperaturen der Halogenwasserstoffe Grafik: Muskid, Sdp-H-Verb, CC BY-SA 3.0↩︎
